
Los beneficios potenciales de los extractos de frutos secos en el
tratamiento del cáncer: Formulaciones emergentes en nanomedicina
Dr. Christian Chapa González
Jefe del grupo de investigación NANOMEDICINA de la UACJ
Dra. Jazmín Cristina Stevens
Barrón
Departamento de Ciencias Veterinarias
Introducción
¿Podrá la nanomedicina con extractos de compuestos bioactivos abrir nuevas fronteras en la investigación contra el cáncer y transformar los tratamientos actuales? Aun no tenemos la respuesta, lo cierto es que nos estamos acercando. Los compuestos bioactivos son sustancias naturales o sintéticas que interactúan con organismos vivos, produciendo efectos biológicos específicos. Estos compuestos pueden tener propiedades beneficiosas para la salud o ser utilizados en tratamientos médicos. Los extractos de compuestos bioactivos se han mostrado efectivos como coadyuvantes en tratamientos contra el cáncer. El cáncer es una enfermedad multifactorial compleja que afecta cada año a millones de personas en todo el mundo [1]. Por ello, si al lector le preguntamos si conoce algún caso en su familia o conocidos sobre cáncer es muy probable que su respuesta sea afirmativa porque se trata de un problema de salud pública mundial muy serio. Nuestro conocimiento acerca de las causas del cáncer ha permitido avanzar hacia nuevas formas de tratamiento, diagnóstico y prevención, pero el cáncer sigue siendo una de las principales causas de muerte a nivel mundial, a pesar de los avances. De hecho, se ha pronosticado que el cáncer siga estando en los primeros lugares de muertes a nivel mundial en los próximos años y sigan creciendo los números de incidencia y mortalidad [2].Hoy en día, los investigadores no descansan en buscar innovaciones en el tratamiento buscando aumentar las tasas de supervivencia y mejorar la calidad de vida de los pacientes. Recientemente se han registrado avances importantes en la investigación, prevención y el tratamiento del cáncer [3] (Figura 1), como en 2006 cuando se aprobó la vacuna contra el virus del papiloma humano (VPH) que causa aproximadamente el 70% de todos los casos de cáncer de cuello de útero; en 2010 la primera, y hasta ahora única, vacuna derivada de células dendríticas (inmunitarias) del paciente de cáncer de próstata metastásico que ya no responde a la terapia hormonal; en 2017, la terapia CAR-T personalizada, que es una terapia inmunológica que utiliza células del sistema inmunitario modificadas genéticamente para atacar células cancerosas, y en 2018 se aprueba el primer fármaco dirigido contra tumores sólidos metastásicos o inoperables que hayan empeorado tras un tratamiento previo en cualquier parte del cuerpo.
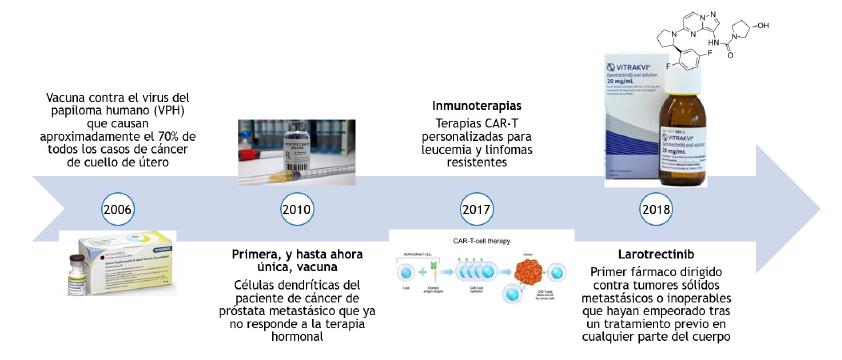
Figura 1. Hitos recientes en la investigación, prevención y el tratamiento del cáncer, elaborado con información de [3]
Los compuestos bioactivos están llamando la atención de investigadores para seguir innovando en tratamientos contra cáncer [4], [5]. En este artículo, veremos cómo la inclusión de compuestos bioactivos, como extractos ricos en tocoles (que son un grupo de compuestos, incluyendo la vitamina E, que protegen las células del daño causado por sustancias oxidantes) o extractos ricos en fenoles (que son moléculas orgánicas presentes en muchas plantas, con propiedades antioxidantes y antiinflamatorias y que se encuentran en alimentos como frutas y verduras), para complementar o mejorar los tratamientos actuales es un ejemplo de la innovación científica continua en la lucha contra el cáncer. Estos compuestos no buscan reemplazar las terapias convencionales, sino potenciar su efectividad. La investigación actual en compuestos bioactivos demuestra que es posible tratar la enfermedad y mejorar la calidad de vida de los pacientes buscando reducir los efectos secundarios de tratamientos actuales como la quimioterapia y la radioterapia.
Especies reactivas de oxígeno (ROS) y su impacto en el cáncer
A pesar de sus efectos secundarios significativos, la quimioterapia sigue siendo la opción más común o el tratamiento estándar para muchos tipos de cáncer. Aunque es eficaz en destruir células cáncerosas, también afecta a las células sanas. Las quimioterapias son responsables de elevar los niveles de unas moléculas denominadas especies reactivas de oxígeno, ROS por sus siglas en inglés para Reactive Oxygen Species [6]. Estas ROS son moléculas de oxígeno altamente reactivas que pueden dañar las células si se producen en exceso. Están involucradas en procesos biológicos normales, pero también en el desarrollo de enfermedades. El equilibrio entre la generación y la eliminación de ROS mantiene el nivel normal de ROS en la célula. En niveles normales, las ROS apoyan las funciones de las células sanas como la defensa inmunológica, la estabilidad genómica, la regulación de la transcripción y traducción; sin embargo, el aumento de los niveles de ROS favorece la inestabilidad genética, acelera la progresión del ciclo celular, la señalización oncogénica, la reprogramación metabólica, el crecimiento celular aberrante [7]. Y si los niveles de ROS continúan aumentando favorecen la muerte de las células cáncerosas, la detención del ciclo celular, la senescencia, la muerte celular (Figura 2). Existen fármacos quimioterapéuticos generadores de oxidantes que son administrados para lograr una sobrecarga de ROS para que las células cáncerosas mueran [8].Los ROS son muy variados y se ha estudiado cuál es su principal fuente, cómo actúan y cuál es su sistema de depuración. Por ejemplo, uno de estos ROS es el peróxido de hidrógeno (H₂O₂), una molécula que puede ser eliminada mediante proteínas específicas conocidas como proteínas diana. Estas proteínas actúan como interruptores redox (un proceso químico que implica transferencia de electrones) en la comunicación celular, a través de un mecanismo llamado modificaciones postraduccionales, donde se producen cambios en moléculas internas, como la oxidación de grupos de azufre y metionina (componentes de las proteínas), así como de centros metálicos en proteínas, selenoproteínas y lípidos oxidados [7]. Otro ROS relevante es el peroxil (ROO·), una molécula que se genera a partir del H₂O₂. Este ROS tiene un efecto dañino directo sobre las membranas celulares a través de un proceso llamado peroxidación, que básicamente "destruye" la estructura de la membrana, provocando la muerte de la célula. Afortunadamente, el organismo cuenta con defensas naturales contra estos radicales, como los antioxidantes intrínsecos, que son moléculas específicas producidas por el cuerpo para neutralizar los ROS y prevenir daños. Sin embargo, cuando los niveles de ROS se acumulan más allá de lo que los antioxidantes intrínsecos pueden manejar, es necesario recurrir a antioxidantes exógenos. Estos son compuestos bioactivos que podemos obtener a través de una dieta rica en alimentos antioxidantes o mediante suplementos nutricionales. Estos antioxidantes ayudan a equilibrar los niveles de ROS, protegiendo a las células de posibles daños.
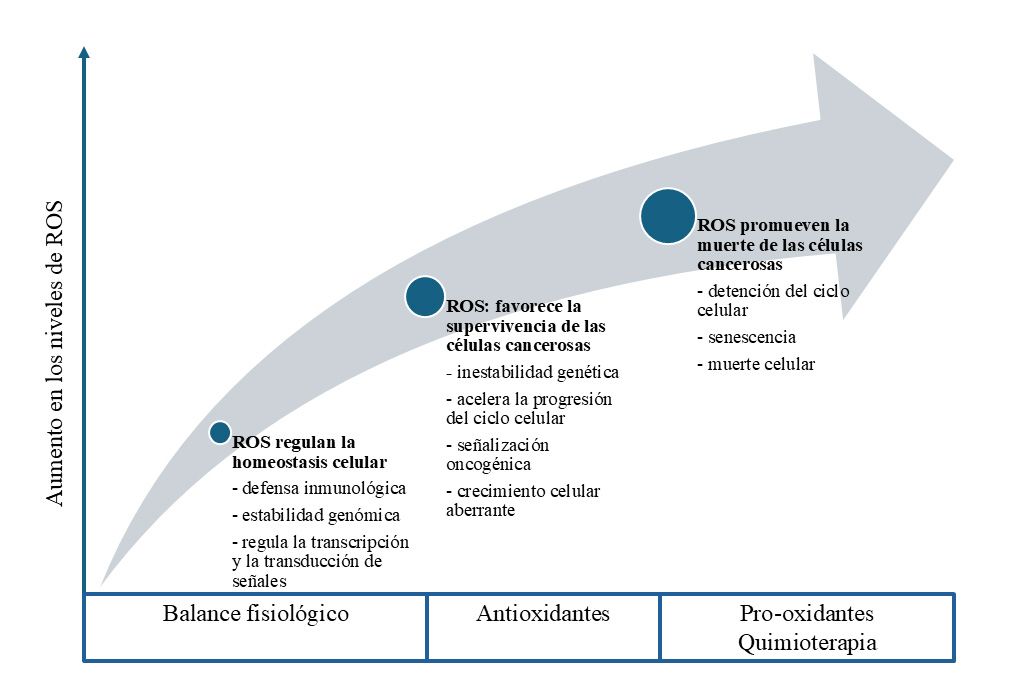
Figura 2. Las especies reactivas del oxígeno (ROS) como agentes de señalización celular y fisiológica. Elaborada con información de [6], [7], [8]
El papel antioxidante de los compuestos bioactivos de los frutos secos
Los compuestos bioactivos son sustancias naturales que, al ser consumidas, pueden tener efectos positivos en la salud. Estos se encuentran en una variedad de alimentos, incluyendo frutas, verduras y, particularmente, en los frutos secos. Entre estos compuestos se destacan los polifenoles, los flavonoides, los ácidos grasos omega-3 y las vitaminas como la E, que tienen propiedades antioxidantes. El principal mecanismo de acción de los antioxidantes es su capacidad para interactuar con las ROS que se producen naturalmente en el cuerpo. Las ROS, aunque necesarias en pequeñas cantidades para funciones celulares, pueden acumularse en niveles elevados bajo ciertas condiciones, como el estrés, la mala alimentación o incluso durante tratamientos como la quimioterapia. Para que las ROS no dañen el ADN, las proteínas y las membranas celulares de las células sanas, se pueden emplear los antioxidantes presentes en los frutos secos, como los tocoferoles y los fenoles, que tienen la capacidad de interceptar y neutralizar estos radicales libres. Por ejemplo, los fenoles, gracias a su estructura química, pueden interactuar con los ROS y reducir su capacidad de dañar las células. En la Figura 3 puede verse algunos compuestos bioactivos derivados de la nuez y un recuadro con la reacción de un polifenol con el radical peroxil. Gracias a esa reacción en consecuencia, no reaccionaría con la membrana, esta es su función antioxidante. En el caso específico de las nueces pecanas, su alto contenido en tocoferoles (vitamina E) y otros compuestos fenólicos ha atraído la atención de la comunidad científica por sus efectos antioxidantes, anti-ROS.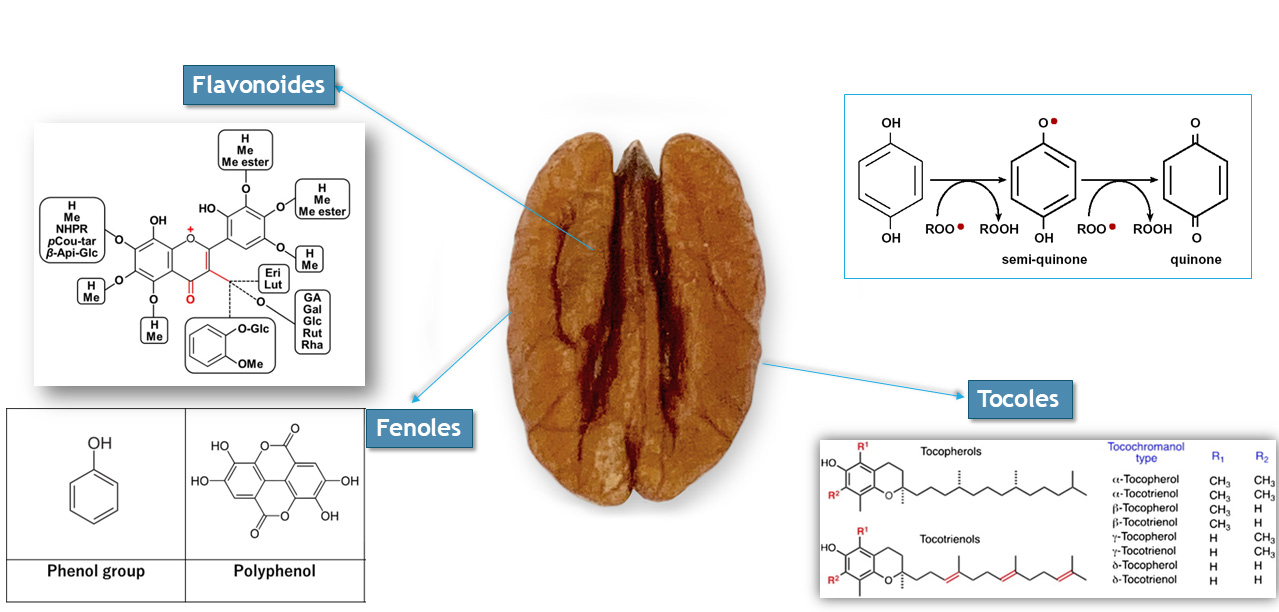
Figura 3. La nuez como fuente de compuestos bioactivos, entre ellos los flavonoides, fenoles y tocoles. En el recuadro se muestra una reacción entre un fenol y una ROS, peroxil ROO, al reaccionar dos ROS son reducidos por una molécula del fenol, mostrando su efecto antioxidante
Evidencia científica sobre los beneficios del consumo de nueces en el cáncer
En consecuencia, la nuez pecana y otros frutos secos se consideran como una fuente rica de antioxidantes. Los ensayos clínicos son estudios de investigación en humanos diseñados para evaluar la seguridad y eficacia de nuevos tratamientos médicos y se llevan a cabo para el desarrollo de nuevos fármacos y terapias. Recientemente, se reunió bastante evidencia científica en ensayos clínicos en donde se demostró el efecto benéfico del consumo de nueces respecto al tratamiento del cáncer. Por ejemplo, en 2015 después de revisar los resultados de 36 ensayos clínicos que incluían más de 30 mil sujetos de estudio se determinó que el consumo de nueces puede contribuir a reducir el riesgo de cáncer colorectal, endometrial y pancreático [9]. En 2019, a mujeres que se les detectó cáncer de mama se les indicó consumir 2 oz. (aproximadamente 56 gramos) de nueces por día hasta el día de la cirugía de extirpación. Los resultados demostraron que el consumo de nuez activó vías metabólicas que promueven la muerte celular (apoptosis) y que se inhibieron vías metabólicas que promueven la proliferación y migración celular. Estos resultados apoyan la hipótesis de que, en humanos, el consumo de nueces podría suprimir el crecimiento y la supervivencia de los cánceres de mama [10]. Luego, en 2022 un análisis tipo “umbrella”, que se considera uno de los niveles más altos de síntesis de evidencia científica disponibles, determinó que una ingesta de 28 gramos de nueces por día está asociada a una reducción del riesgo de muerte por cáncer [11]. Si bien, toda esta evidencia está basada en el consumo de nueces, es posible obtener los beneficios mediante extractos de los compuestos bioactivos.En los últimos años se ha formulado quimioterapias en conjunto con derivados de compuestos bioactivos. Además, el campo de la nanomedicina ha abierto nuevas puertas para optimizar el uso de estos compuestos, brindando innovadoras terapias complementarias a los tratamientos convencionales. Por ejemplo, en 2018 se estudiaron unas nanoestructuras liposomas de tocoferoles cargados de vincristina, un medicamento de quimioterapia que se utiliza para tratar diferentes tipos de cáncer, como la leucemia, el linfoma, el mieloma, el cáncer de mama, el cáncer de cabeza y cuello, y los sarcomas de tejidos blandos [12]. En ese estudio se determinó que las formulaciones que combinan los fármacos con compuesto bioactivos son estables, por lo que sí es posible la combinación de quimioterapias con extractos de frutos secos ricos en tocoferoles o tocotrienoles. En 2020, examinaron la aplicación potencial de la formulación de ɑ-tocotrienol para mejorar la eficiencia de la doxorrubicina, un fármaco ampliamente utilizado en la quimioterapia del cáncer, en hepatocarcinoma, el tipo de cáncer de hígado más común y la quinta causa de muerte por cáncer en el mundo [13]. La combinación de extractos ricos en compuestos tocoles o fenoles parece ser prometedor hacia nuestra búsqueda de tratamientos más seguros y eficaces [14].
Aunque se requieren más ensayos clínicos para acumular evidencia sobre el efecto benéfico de la combinación de quimioterapias con compuestos bioactivos o extractos que sean más seguros y eficaces disminuyendo los efectos adversos, los investigadores están dando pasos en ese sentido. Por ejemplo, se estudiaron las interacciones entre extractos ricos en tocoles y extractos ricos en fenoles de nueces con células de varios tipos de cáncer y, en general, se observó que los extractos de frutos secos efectivamente actúan de forma sinérgica para provocar la muerte de estas células [15]. Además, en 2020 se emplearon extractos de menta en pacientes con cáncer de mama , en 2022 setas shiitake en desórdenes relacionados al cáncer de páncreas [16] y extractos de brotes de brócoli en pacientes con cáncer de mama [17] y en 2024 extractos de muérdago en pacientes con cáncer pancreático avanzado [18]. El énfasis está en lograr el equilibrio entre los niveles de ROS causados por las quimioterapias y aprovechar los efectos antioxidantes de los extractos para equilibrar los niveles adecuados de ROS en las células sanas. Existe evidencia sobre los beneficios de complementar las terapias con tocoferoles o tocotrienoles en cáncer de próstata [19] y cáncer de ovarios [20]. Los resultados de estudios en humanos y en laboratorio sobre las actividades preventivas del cáncer de diferentes formas de tocoferoles y tocotrienoles son prometedoras. Por esa razón, es factible proponer formulaciones elaborados con extractos de nuez pecana, que como se comentó anteriormente es muy rica en compuestos bioactivos, dirigidos al desarrollo de terapias adyuvantes, es decir, tratamientos que complementen los métodos convencionales. Esto se ha vuelto una prioridad de los investigadores en la lucha contra esta enfermedad.
Afortunadamente, Chihuahua, México es una región productora una región altamente productora de la nuez pecana y ocupa un lugar de producción muy importante a nivel mundial. Por ello puede aprovecharse para desarrollar formulaciones para ofrecer soluciones encaminadas hacia la mejora de las terapias actuales de cáncer que este estado también ocupa los primeros lugares en incidencia y mortalidad. Particularmente la leucemia ocupa el primer lugar en los rangos de edad desde cero hasta 29 años en la población de hombres y mujeres en México. Por esa razón, se están investigando las formulaciones de nanomedicina con los compuestos bioactivos extraídos de la nuez pecana como un enfoque novedoso de las nuevas fronteras en el tratamiento del cáncer. Se busca analizar el efecto de tocoles y fenoles sobre el estado de células normales y cáncerosos, así como su sensibilización a agentes terapéuticos, particularmente en los tipos de cáncer con mayor incidencia en Chihuahua, como el cáncer colorectal y la leucemia linfoblástica aguda, entre otros.
La creciente adopción de métodos basados en la nanomedicina para tratamiento del cáncer
Por otro lado, la nanomedicina es un campo interdisciplinario, disruptivo que utiliza materiales a escala nanométrica (mil veces más pequeños que un cabello humano) para mejorar la administración de medicamentos y tratar enfermedades de manera más precisa. Se espera que los avances significativos y la reciente comercialización de productos, como las vacunas basadas en ARNm y liposomas, impulsen el crecimiento de las nanomedicinas en un futuro próximo. Además, la creciente adopción de métodos basados en la nanotecnología para la administración de fármacos y la ineficacia prevalente de las terapias convencionales representan perspectivas de crecimiento emergentes para la industria de la nanomedicina, cuyo principal desafío en el tratamiento del cáncer es atacar selectivamente las células cáncerosas sin dañar las células sanas. Aquí es donde la nanomedicina tiene el potencial de revolucionar el campo.Por todo lo anterior, la encapsulación de los compuestos bioactivos que se extraen de los frutos secos, como la nuez pecana, en sistemas de nanomedicina como nanopartículas de oro, nanofibras electrohiladas, liposomas, micro- y nanoemulsiones, entre otros sistemas de nanomedicina ofrece un panorama prometedor. Estos sistemas de nanomedicina permitirían una liberación controlada y prolongada de los compuestos, mejorando su estabilidad y biodisponibilidad en el organismo. Además, pueden ser diseñados para administrarse por diferentes vías y para dirigirse específicamente a las células tumorales, aumentando la eficacia del tratamiento y reduciendo los efectos secundarios.
Conclusión
Los avances en la investigación científica de las propiedades beneficiosas de los compuestos bioactivos, extractos ricos en tocoles y fenoles, en sistemas de nanomedicina otorgan una perspectiva que hasta ahora es prometedor. Sin embargo, aún queda un largo camino por recorrer en la investigación científica antes de que los extractos de frutos secos encapsulados en sistemas de nanomedicina puedan ser utilizados de manera rutinaria en los tratamientos oncológicos. Se necesitan varios proyectos de investigación y estudios que evalúen su seguridad y eficacia en humanos, determinar las dosis óptimas y los posibles efectos secundarios a largo plazo. Para llegar a ese punto es imperativo consolidar una infraestructura científica dedicada al desarrollo de las investigaciones, especialmente en áreas interdisciplinarias como la nanomedicina, donde convergen campos como la ingeniería biomédica, la química y la medicina. Esto facilitaría, a la vez, la integración de estudiantes y la formación de nuevos investigadores, contribuyendo al crecimiento académico y al desarrollo de proyectos de investigación a largo plazo. Además, este tipo de proyectos científicos requiere establecer redes de colaboración formales y eficientes entre distintos grupos de investigación, ampliando las posibilidades de llevar a cabo investigaciones de fases preclínicas y clínicas, que eventualmente podrían mejorar la vida de millones de personas. Si ya hemos avanzado tanto con compuestos bioactivos y nanomedicina, ¿qué descubrimientos nos esperan si seguimos explorando?Referencias
[2] “Cáncer: The Silent Pandemic | ACS.” Accessed: Sep. 21, 2024. [Online]. Available: https://www.facs.org/for-medical-professionals/news-publications/news-and-articles/bulletin/2022/01/cáncer-the-silent-pandemic/
[3] “Milestones in Cáncer Research and Discovery - NCI.” Accessed: Sep. 30, 2024. [Online]. Available: https://www.cáncer.gov/research/progress/250-years-milestones
[4] D. S. Mousa, A. H. El-Far, A. A. Saddiq, T. Sudha, and S. A. Mousa, “Nanoformulated bioactive compounds derived from different natural products combat pancreatic cáncer cell proliferation,” Int J Nanomedicine, vol. 15, pp. 2259–2268, 2020, https://www.doi.org/10.2147/IJN.S238256.
[5] K. Ganesan, B. Du, and J. Chen, “Effects and mechanisms of dietary bioactive compounds on breast cáncer prevention,” Pharmacol Res, vol. 178, p. 105974, 2022, https://doi.org/10.1016/j.phrs.2021.105974.
[6] B. Perillo et al., “ROS in cáncer therapy: the bright side of the moon,” Experimental & Molecular Medicine 2020 52:2, vol. 52, no. 2, pp. 192–203, Feb. 2020, https://www.doi.org/10.1038/s12276-020-0384-2.
[7] H. Sies and D. P. Jones, “Reactive oxygen species (ROS) as pleiotropic physiological signalling agents,” Nature Reviews Molecular Cell Biology 2020 21:7, vol. 21, no. 7, pp. 363–383, Mar. 2020, https://www.doi.org/10.1038/s41580-020-0230-3.
[8] S. K. Reddy Padi, S. S. Chauhan, and N. Singh, “ROS Induced by Chemo- and Targeted Therapy Promote Apoptosis in Cáncer Cells,” Handbook of Oxidative Stress in Cáncer: Mechanistic Aspects, vol. 1, pp. 583–598, Jan. 2022, https://www.doi.org/10.1007/978-981-15-9411-3_47.
[9] L. Wu, Z. Wang, J. Zhu, A. L. Murad, L. J. Prokop, and M. H. Murad, “Nut consumption and risk of cáncer and type 2 diabetes: a systematic review and meta-analysis,” Nutr Rev, vol. 73, no. 7, pp. 409–425, Jul. 2015, https://www.doi.org/10.1093/NUTRIT/NUV006.
[10] W. E. Hardman, D. A. Primerano, M. T. Legenza, J. Morgan, J. Fan, and J. Denvir, “Dietary walnut altered gene expressions related to tumor growth, survival, and metastasis in breast cáncer patients: a pilot clinical trial,” Nutr Res, vol. 66, pp. 82–94, Jun. 2019, https://www.doi.org/10.1016/J.NUTRES.2019.03.004.
[11] R. Balakrishna, T. Bjørnerud, M. Bemanian, D. Aune, and L. T. Fadnes, “Consumption of Nuts and Seeds and Health Outcomes Including Cardiovascular Disease, Diabetes and Metabolic Disease, Cáncer, and Mortality: An Umbrella Review,” Adv Nutr, vol. 13, no. 6, pp. 2136–2148, Nov. 2022, https://www.doi.org/10.1093/ADVANCES/NMAC077.
[12] Y. Yang et al., “Vincristine-loaded liposomes prepared by ion-paring techniques: Effect of lipid, pH and antioxidant on chemical stability,” Eur J Pharm Sci, vol. 111, pp. 104–112, Jan. 2018, https://www.doi.org/10.1016/J.EJPS.2017.09.045.
[13] E. B. Lages et al., “pH-sensitive doxorubicin-tocopherol succinate prodrug encapsulated in docosahexaenoic acid-based nanostructured lipid carriers: An effective strategy to improve pharmacokinetics and reduce toxic effects,” Biomed Pharmacother, vol. 144, Dec. 2021, https://www.doi.org/10.1016/J.BIOPHA.2021.112373.
[14] C. S. Yang, P. Luo, Z. Zeng, H. Wang, M. Malafa, and N. Suh, “Vitamin E and cáncer prevention: Studies with different forms of tocopherols and tocotrienols,” Mol Carcinog, vol. 59, no. 4, pp. 365–389, Apr. 2020, https://www.doi.org/10.1002/MC.23160.
[15] J. C. Stevens-Barrón et al., “Synergistic Interactions between Tocol and Phenolic Extracts from Different Tree Nut Species against Human Cáncer Cell Lines,” Molecules, vol. 27, no. 10, p. 3154, May 2022, https://www.doi.org/10.3390/MOLECULES27103154/S1.
[16] H. Yanagimoto, S. Hirooka, T. Yamamoto, S. Yamaki, and M. Sekimoto, “Efficacy of Lentinula edodes Mycelia Extract on Chemotherapy-Related Tasted Disorders in Pancreatic Cáncer Patients,” Nutr Cáncer, vol. 75, no. 1, pp. 236–246, 2023, https://www.doi.org/10.1080/01635581.2022.2107226.
[17] Z. Wang et al., “A Presurgical-Window Intervention Trial of Isothiocyanate-Rich Broccoli Sprout Extract in Patients with Breast Cáncer,” Mol Nutr Food Res, vol. 66, no. 12, Jun. 2022, https://www.doi.org/10.1002/MNFR.202101094.
[18] K. Wode et al., “Mistletoe Extract in Patients With Advanced Pancreatic Cáncer: a Double-Blind, Randomized, Placebo-Controlled Tial (MISTRAL),” Dtsch Arztebl Int, vol. 121, no. 11, pp. 347–354, 2024, https://www.doi.org/10.3238/ARZTEBL.M2024.0080.
[19] F. Fontana et al., “δ-Tocotrienol induces apoptosis, involving endoplasmic reticulum stress and autophagy, and paraptosis in prostate cáncer cells,” Cell Prolif, vol. 52, no. 3, May 2019, https://www.doi.org/10.1111/CPR.12576.
[20] F. Fontana, M. Marzagalli, M. Raimondi, V. Zuco, N. Zaffaroni, and P. Limonta, “δ-Tocotrienol sensitizes and re-sensitizes ovarian cáncer cells to cisplatin via induction of G1 phase cell cycle arrest and ROS/MAPK-mediated apoptosis,” Cell Prolif, vol. 54, no. 11, Nov. 2021, https://www.doi.org/10.1111/CPR.13111.