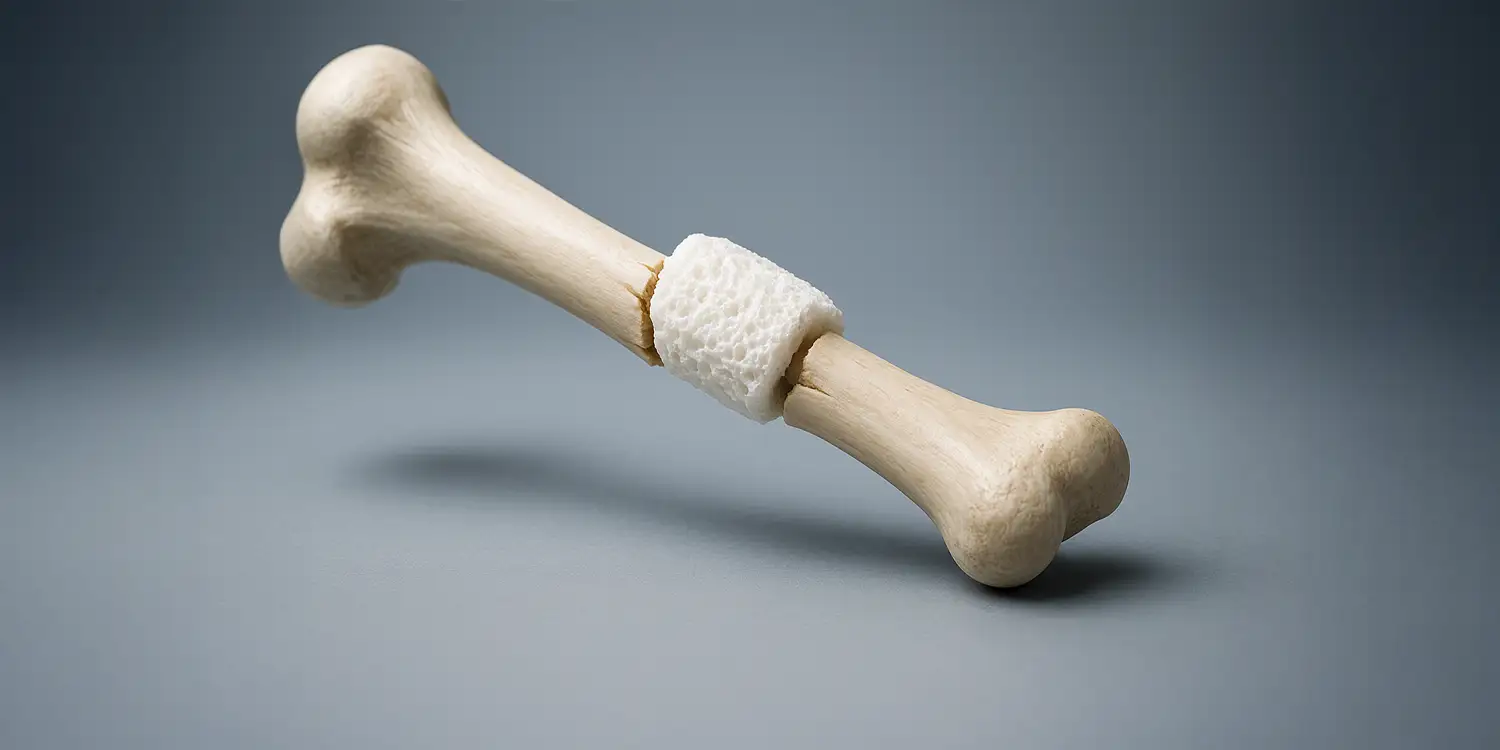
De la fractura a la regeneración ósea: cuando el soporte se vuelve parte
del cuerpo
I.B. Melva Alejandra Martínez Flores / Ingeniera Biomédica egresada de la UACJ
Dra. Amanda Carrillo Castillo / Universidad Autónoma de Ciudad Juarez
Dr. Christian Chapa González / NANOMEDICINA de la UACJ
Descubre cómo el Bioglass 45S5 y los polímeros reabsorbibles trabajan juntos para reparar el tejido óseo dañado y facilitar su regeneración.
Resumen
Cada vez que una persona sufre un defecto óseo, como una fractura, se enfrenta a un proceso de rehabilitación que puede ser lento y doloroso, sin contar el largo tiempo durante el cual la extremidad permanece inmóvil, lo que en muchas ocasiones impide la autonomía para realizar actividades cotidianas. Aunque nuestro cuerpo posee una notable capacidad para reparar el hueso dañado, en algunos casos necesita ayuda adicional para recuperarse adecuadamente y de forma rápida. Especialmente cuando la pérdida ósea es considerable, los tratamientos tradicionales como injertos o prótesis no siempre logran una integración exitosa con el cuerpo. Ante este desafío, se han desarrollado combinaciones de materiales cerámicos aglutinados por polímeros, complementando las propiedades físicas y biológicas de ambos, para crear un material eficiente en el tratamiento de defectos óseos.
Introducción
Cada vez que una persona sufre un defecto óseo, como una fractura, se enfrenta a un proceso de rehabilitación que puede ser lento y doloroso, sin contar el largo tiempo durante el cual la extremidad permanece inmóvil, lo que en muchas ocasiones impide la autonomía para realizar actividades cotidianas. Aunque nuestro cuerpo posee una notable capacidad para reparar el hueso dañado, en algunos casos necesita ayuda adicional para recuperarse adecuadamente y de forma rápida. Especialmente cuando la pérdida ósea es considerable, los tratamientos tradicionales como injertos o prótesis no siempre logran una integración exitosa con el cuerpo. Ante este desafío, se han desarrollado combinaciones de materiales cerámicos aglutinados por polímeros, complementando las propiedades físicas y biológicas de ambos, para crear un material eficiente en el tratamiento de defectos óseos [1].
Cerámico bioactivo
El Bioglass 45S5 es uno de los materiales utilizados para crear estructuras temporales que actúan
como guía para el crecimiento del nuevo tejido. Está compuesto por elementos como silicio, calcio,
sodio y fósforo, todos ellos compatibles con nuestro cuerpo [2]. Lo especial de este material es que
es bioactivo, lo que significa que no solo está presente en el cuerpo, sino que interactúa con él.
Cuando el Bioglass entra en contacto con los fluidos corporales, reacciona formando una capa de
hidroxiapatita, un mineral que constituye la base del tejido óseo. Esta capa estimula a las células
óseas a crecer sobre la zona aplicada y reconstruir el hueso de manera natural [3].
Este material fue desarrollado en 1969 por el Dr. Larry Hench, un investigador que
originalmente no
buscaba un material para reparar huesos, sino que experimentaba con materiales resistentes a
condiciones extremas, como las que enfrentan las armas militares [4]. Sin embargo, durante el
desarrollo, Hench notó que una de sus formulaciones tenía una interacción inusual con los fluidos
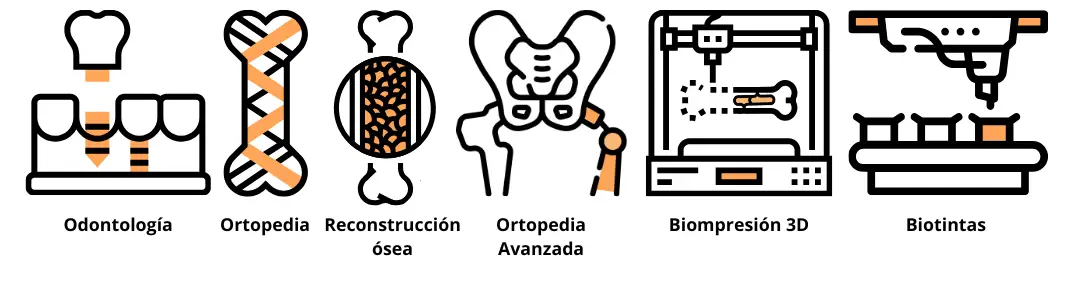
biológicos [5]. A lo largo del tiempo, las aplicaciones de este material se han expandido desde la
odontología hasta áreas más complejas como la ortopedia avanzada, enfocada en la integración de
endoprótesis (implantes internos) en tejido óseo dañado, y tecnologías emergentes como la
bioimpresión (Figura 1).
Aglutinantes: Polímeros biodegradables
Los polímeros biodegradables son materiales sintéticos diseñados para descomponerse de forma natural
y gradual dentro del cuerpo o en el ambiente, sin dejar residuos tóxicos [6]. Su principal ventaja
es que cumplen una función temporal: proporcionan soporte mientras el tejido se regenera y luego se
degradan lentamente hasta desaparecer por completo, sin requerir una segunda cirugía para
retirarlos, como sí ocurre con los metales y aleaciones [7], [8].
Algunos de los materiales más utilizados en regeneración ósea son:
- Ácido Poliláctico (PLA): valorado por su resistencia y biodegradabilidad controlada [9].
- Polivinilpirrolidona (PVP): ofrece flexibilidad y biocompatibilidad, es decir, no produce reacciones adversas al estar en contacto con el cuerpo [10].
- Polietilenglicol (PEG): favorece la hidratación del tejido y reduce las respuestas inflamatorias [11].
- Alcohol Polivinílico (PVA): aporta soporte mecánico y porosidad adecuada para permitir el crecimiento celular [12].
Estructuras bioactivas: fusionando tecnología y biología
Actualmente, esta combinación de materiales se utiliza en diversas áreas médicas donde se requiere
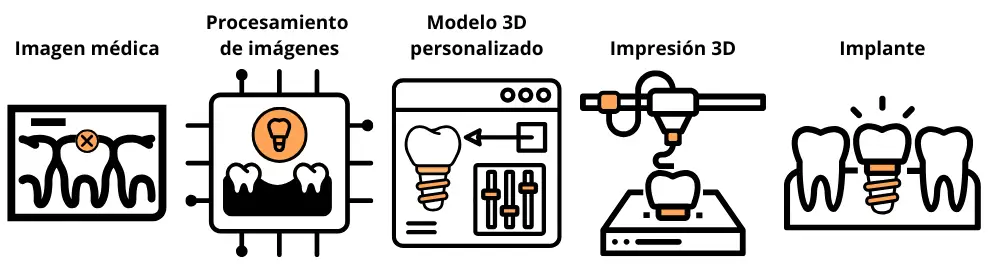
promover la regeneración ósea o mejorar la integración de implantes [13]. En odontología, se emplea
como recubrimiento en implantes dentales para mejorar la unión entre el tornillo y el hueso de la
mandíbula [14]. En traumatología, se usa para reparar fracturas complejas y expuestas, actuando como
relleno bioactivo en zonas donde el hueso ha sido dañado o perdido, en combinación con placas,
tornillos o clavos [15]. También se aplica en cirugía maxilofacial y reconstrucciones por trauma o
cáncer, rellenando defectos óseos y estimulando la regeneración [16].
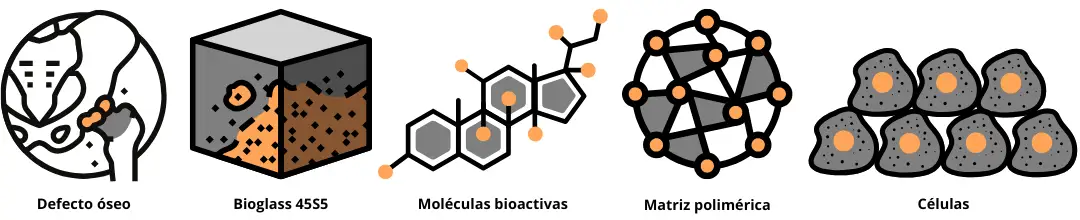
El diseño de estos materiales busca imitar las características físicas y químicas de la
matriz
extracelular, una red natural que rodea las células y les brinda soporte estructural y señales
bioquímicas [17]. Esta matriz permite que las células óseas se adhieran, se especialicen y comiencen
a formar hueso nuevo de manera organizada (Figura 2).
Uno de los aspectos más importantes al colocar un material en un defecto óseo es su
porosidad: debe
presentar canales y espacios que permitan el paso de nutrientes, oxígeno y células para el
crecimiento del nuevo tejido [18]. Si la estructura fuera completamente cerrada, impediría la
regeneración, actuando más como barrera que como guía [19].
Estas estructuras no están diseñadas para ser permanentes ni rígidas como una prótesis tradicional. Son porosas, se implantan dentro del cuerpo y funcionan como un “esqueleto temporal” que orienta a las células en la reconstrucción de la zona afectada [22].
El futuro de la regeneración ósea
La investigación actual sobre materiales aglutinantes para el Bioglass continúa explorando mejoras en
su formulación y diseño, con el fin de optimizar su eficacia, reducir los tiempos de recuperación y
mejorar la calidad de vida de los pacientes. Lo que antes parecía ciencia ficción, hoy forma parte
de tratamientos médicos avanzados en regeneración ósea [23].
Uno de los avances más prometedores es el desarrollo de biotintas, materiales que combinan
polímeros
con células vivas, especialmente formulados para su uso en bioimpresoras 3D. Estas impresoras
permiten crear estructuras que imitan la forma del hueso dañado, así como su composición interna y
comportamiento biológico (Figura 3) [24].
Conclusión
El diseño personalizado de estructuras óseas, junto con la incorporación de polímeros reabsorbibles
al Bioglass 45S5, marca un hito en la medicina regenerativa. Esta combinación permite crear andamios
que se adaptan con precisión al cuerpo humano y, al mismo tiempo, lo estimulan a regenerarse por sí
mismo. Al integrar materiales con propiedades complementarias, se logran tratamientos más efectivos,
menos invasivos y adaptados a las necesidades de cada paciente.
Estas innovaciones reflejan una nueva visión de la salud, donde la ciencia, la tecnología y
la
ingeniería convergen para ofrecer soluciones biológicamente personalizadas y más accesibles. Una
forma de sanar que repara lo dañado y acompaña al cuerpo en su propio proceso de reconstrucción. Un
ejemplo claro de cómo la ciencia puede transformar vidas, hueso por hueso.
Referencias
[2] A. Pugely, “Influence of 45S5 Bioactive Glass in A Standard Calcium Phosphate Collagen Bone Graft Substitute on the Posterolateral Fusion of Rabbit Spine,” Iowa Orthop J, 2021. [En línea]. Disponible: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8372710/
[3] F. Baino, G. Novajra, and C. Vitale-Brovarone, “Bioceramics and scaffolds: A winning combination for tissue engineering,” 2015, Frontiers Media S.A. doi: https://doi.org/10.3389/fbioe.2015.00202.
[4] L. Hench, “The story of Bioglass®,” J. Mater. Sci. Mater. Med., vol. 17, no. 11, pp. 967–978, Nov. 2006. doi: https://doi.org/10.1007/s10856-006-0432-z.
[5] A. Hoppe, N. S. Güldal, and A. R. Boccaccini, “A review of the biological response to ionic dissolution products from bioactive glasses and glass-ceramics,” Biomaterials, vol. 32, no. 11, pp. 2757–2774, Apr. 2011. doi: https://doi.org/10.1016/J.BIOMATERIALS.2011.01.004.
[6] A. Martelli, D. Bellucci, and V. Cannillo, “Additive Manufacturing of Polymer/Bioactive Glass Scaffolds for Regenerative Medicine: A Review,” Jun. 01, 2023, MDPI. doi: https://doi.org/10.3390/polym15112473.
[7] N. Mani, A. Sola, A. Trinchi, and K. Fox, “Is there a future for additive manufactured titanium bioglass composites in biomedical application? A perspective,” Biointerphases, vol. 15, no. 6, Nov. 2020. doi: https://doi.org/10.1116/6.0000557.
[8] J. N. Oliver, Y. Su, X. Lu, P. H. Kuo, J. Du, and D. Zhu, “Bioactive glass coatings on metallic implants for biomedical applications,” Dec. 01, 2019, KeAi Communications Co. doi: https://doi.org/10.1016/j.bioactmat.2019.09.002.
[9] N. Söhling et al., “In vitro Evaluation of a 20% Bioglass-Containing 3D printable PLA Composite for Bone Tissue Engineering,” Int. J. Bioprint., vol. 8, no. 4, pp. 65–81, 2022. doi: https://doi.org/10.18063/ijb.v8i4.602.
[10] Q. Yao et al., “Multifunctional chitosan/polyvinyl pyrrolidone/45S5 Bioglass® scaffolds for MC3T3-E1 cell stimulation and drug release,” Mater. Sci. Eng. C, vol. 56, pp. 473–480, Jul. 2015. doi: https://doi.org/10.1016/j.msec.2015.06.046.
[11] Y. Liu et al., “A strategy to tailor the mechanical and degradation properties of PCL-PEG-PCL based copolymers for biomedical application,” Eur. Polym. J., vol. 198, p. 112388, Oct. 2023. doi: https://doi.org/10.1016/J.EURPOLYMJ.2023.112388.
[12] N. Shankhwar, M. Kumar, B. B. Mandal, and A. Srinivasan, “Novel polyvinyl alcohol-bioglass 45S5 based composite nanofibrous membranes as bone scaffolds,” Mater. Sci. Eng. C, vol. 69, pp. 1167–1174, Dec. 2016. doi: https://doi.org/10.1016/j.msec.2016.08.018.
[13] L. Hench, “Chronology of Bioactive Glass Development and Clinical Applications,” New J. Glass Ceram., vol. 03, no. 02, pp. 67–73, 2013. doi: https://doi.org/10.4236/njgc.2013.32011.
[14] L. Felipe et al., “Resistencia a la Fractura de Dientes Tratados Endodónticamente Obturados con Selladores Biocerámicos Versus Selladores Resinosos. Revisión Sistemática,” 2019. [En línea]. Disponible: https://revistas.unal.edu.co/index.php/actaodontocol/article/view/79123
[15] D. Nogueira et al., “Biological Behavior of Bioactive Glasses SinGlass (45S5) and SinGlass High (F18) in the Repair of Critical Bone Defects,” Biomolecules, vol. 15, no. 1, Jan. 2025. doi: https://doi.org/10.3390/biom15010112.
[16] V. Bermúdez García et al., “Obtención de hidroxiapatita a través de residuos biológicos para injertos óseos dentales,” Rev. Estomatol. Herediana, vol. 31, no. 2, pp. 111–116, Jul. 2021. doi:
https://doi.org/10.20453/reh.v31i2.3971.
[17] L. Vasconcellos et al., “Electrospun poly(Butylene-adipate-co-terephthalate)/nano-hydroxyapatite/graphene nanoribbon scaffolds improved the in vivo osteogenesis of the neoformed bone,” J. Funct. Biomater., vol. 12, no. 1, Mar. 2021. doi: https://doi.org/10.3390/jfb12010011.
[18] E. Zeimaran et al., “Bioactive glass reinforced elastomer composites for skeletal regeneration: A review,” Aug. 01, 2015. doi: https://doi.org/10.1016/j.msec.2015.04.035.
[19] S. Park et al., “Bone formation by Irisin-Poly vinyl alchol modified bioglass ceramic beads in the rabbit model,” J. Mater. Sci. Mater. Med., vol. 35, no. 1, Dec. 2024. doi: https://doi.org/10.1007/s10856-024-06788-w.
[20] L. Mendoza-Cerezo et al., “Fabrication and characterisation of bioglass and hydroxyapatite-filled scaffolds,” J. Mech. Behav. Biomed. Mater., vol. 144, Aug. 2023. doi: https://doi.org/10.1016/j.jmbbm.2023.105937.
[21] E. Mancuso et al., “Three-dimensional printing of porous load-bearing bioceramic scaffolds,” Proc. Inst. Mech. Eng. H, vol. 231, no. 6, pp. 575–585, Jun. 2017. doi: https://doi.org/10.1177/0954411916682984.
[22] B. Thavornyutikarn et al., “Porous 45S5 Bioglass®-based scaffolds using stereolithography: Effect of partial pre-sintering on structural and mechanical properties of scaffolds,” Mater. Sci. Eng. C, vol. 75, pp. 1281–1288, Jun. 2017. doi: https://doi.org/10.1016/j.msec.2017.03.001.
[23] A. Szwed-Georgiou et al., “Bioactive Materials for Bone Regeneration: Biomolecules and Delivery Systems,” 2023, American Chemical Society. doi: https://doi.org/10.1021/acsbiomaterials.3c00609.
[24] W. L. Ng, S. Wang, W. Y. Yeong, and M. W. Naing, “Skin Bioprinting: Impending Reality or Fantasy?” Trends Biotechnol., vol. 34, no. 9, pp. 689–699, 2016. doi: https://doi.org/10.1016/j.tibtech.2016.04.006.
[25] D. Reboledo-Grau and G. Martínez-Bordes, “Metodología para el diseño computacional de andamios a ser utilizados en reparación ósea,” Rev. UIS Ing., vol. 19, no. 4, pp. 301–314, Jun. 2020. doi: https://doi.org/10.18273/revuin.v19n4-2020025.